בדומה לבני אדם, מקיימים גם חלבונים אינטראקציות עם חלבונים אחרים ומשתתפים ב"רשתות חברתיות". חלק מהחלבונים הינם "חברותיים" יותר, ז"א בעלי מספר רב של חלבונים אליהם הם נקשרים, ואילו חלבונים אחרים מקיימים קשרים רק עם מעט "חברים" נבחרים.
כל אינטראקציה בין שני חלבונים מאופיינת ע"י זיקת קישור מסוימת (זיקת קישור אט אפיניות קישור – מידת החוזק שבה מולקולה אחת קושרת מולקולה אחרת). מוטציות בחלבונים יכולות לגרום לשינוי בזיקה זו - לעיתים הן מבטלות, ולעיתים הן מייצבות את האינטראקציה.
השינוי בזיקת הקישור של זוג חלבונים המצויים באינטראקציה יכול לגרום לשינוי של כלל רשת החלבונים, ולעתים קרובות להוביל לעירעור הבקרה של הרשת ולמחלה. לפיכך, ההבנה כיצד מוטציות ספציפיות בקומפלקסים חלבוניים משפיעות על זיקת הקישור ויציבות הקומפלקס חשובה ביותר הן לביולוגיה בסיסית והן למדעים ביו-רפואיים. עיכוב של אינטראקציה מסוימת בין חלבונים עשוי לסייע בטיפול במחלה הקשורה לחלבונים אלה.
עד כה הגישות המקובלות למדידת שינויים בזיקת הקישור כתוצאה ממוטציות היו מייגעות, והיה צורך בחודשים עד שנים כדי לאסוף נתונים עבור מאות מוטציות.
לאחרונה, פיתח מייקל היין ממעבדתה של פרופ' שיפמן, בשיתוף פעולה עם ניב פאפו מאוניברסיטת בן גוריון, שיטה חדשה המאפשרת לקבוע את נתוני הזיקה עבור אלפי חלבונים מוטנטים בניסוי אחד.
הגישה שלנו משלבת טכנולוגיית תצוגה על פני שמרים עם ריצוף עמוק (deep sequencing) ונירמול הנתונים, ומפיקה נתוני זיקה דומים מאוד לאלה שנקבעו באמצעות השיטות הניסוייות המקובלות, שהינן בעלות תפוקה נמוכה.
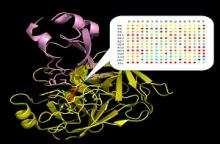
בעזרת מתודולוגיה עוצמתית זו, מדדנו שינויים בזיקת קישור עבור כלל המוטנטים בעלי המוטאציות הבודדות בקומפלקס בין האנזים טריפסין לבין המעכב שלו BPTI (שאף הוא חלבון). המדידות הראו כי קומפלקס חלבון-חלבון זה מותאם ביותר מבחינה אבולוציונית - מוטציה נקודתית אחת בלבד הובילה לשיפור האפיניות, ואילו כל יתר המוטציות הבודדות שנבדקו הרסו לחלוטין את האינטראקציה.
היישום של גישתנו לקומפלקסים חלבוניים רבים נוספים יסייע לנו להבין כיצד אינטראקציות בין חלבונים מופיעות ונעלמות. בנוסף, ניתן להשתמש בגישה שלנו לצורך עיצוב תרופות מבוססות חלבון, שהינן בעלות זיקה גבוהה לֹחלבון המטרה בגופו של המטופל.